 |
| X光可以看到在第十二胸椎及第一腰椎有骨侵蝕(bone erosion)的情形,第十二胸椎下方終板(endplate)有顯著破壞 |
從X光可以看到主要病灶在 第十二胸與第一腰椎之間, 第十二胸椎椎體下方的終板(endplate)已有明顯的破壞(destruction)的情形。
簡女士抱怨背部疼痛,起身活動很困難,且晚上平躺時也持續疼痛, 最近還感到兩側大腿比較無力。
抽血檢查發現發炎指數 CRP=70 mg/dL, 正常是<5 mg/dL,強烈懷疑是脊椎感染,因此安排了核磁共振(MRI)檢查。
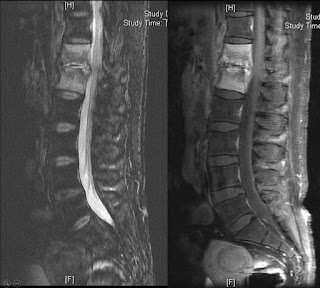 |
| MRI 檢查,證實第十二胸椎及第一腰椎的感染,椎管因為前側的感染組織有些微壓迫 |
核磁共振檢查結果確定是脊椎骨髓炎及椎間盤感染 (Infectious spondylodiskitis
脊椎感染大部分屬於抗生素治療為主,但發生以下情況時可以考慮手術治療:
1 .即使經過抗生素治療仍然感染控制不良
2. 感染造成的脊椎結構不穩定導致劇烈疼痛
3. 因為感染造成了神經壓迫症狀需手術解除
4. 感染合併有較多的膿瘍產生,即早手術清創幫助感染的控制
5. 其他任何手術的施行對於病患有幫助的情形
另外手術時可以取得較大量的檢體做細菌培養, 如果可以培養出明確的病原菌,這樣抗生素的使用可以更有針對性。
因為簡女士已經在外院有治療過但效果不佳, 背痛無法改善,同時又合併了雙側大腿的無力, 與病患討論後, 決定施行手術治療
手術治療的原則是 (1) 對於感染部位給予有效且足夠的清創 (2) 對於脊椎結構穩定給予支撐(或減少破壞), 幫助症狀的緩解。
有人可能會質疑, 在骨骼部位遇到感染的狀況時,內固定器往往會導致有細菌的附著增加感染風險,但結構不穩定時脊椎內固定器亦有需要使用來維持脊椎的穩定性來減輕症狀。
其實已有研究顯示當脊椎處於較好的穩定度時感染較容易控制, 且因為脊椎部位的血流分布較佳,抗生素較容易到達病灶, 因此脊椎內固定器使用並不是脊椎感染的禁忌症(當然如果手術能達到治療的效果且不需要放置內固定器是理想的)。
而我們之前的許多經驗也已證實脊椎內固定器使用在脊椎感染清創手術後使用仍能夠取得相當高的成功率。
此次選擇的手術方法是經由後側路徑經雙側椎孔椎間盤感染清創手術合併自體骨移植補骨及內固定器使用。
手術時盡量保留脊椎後側的結構,包括脊椎脊突,脊突間韌帶,椎板等等。
利用此方法可以達到相當程度的清創, 清除的感染及壞死組織並不亞於從後腹腔路徑的清創手術。
 |
| 手術清出感染的組織 |
經過徹底清創之後再將混合著抗生素的自體骨填補在清創後的空間(Impaction bone grafting)並置入脊椎鋼釘固定穩定脊椎。
 |
| 手術後當天的X光, 鋼釘從第十一胸椎到第二腰椎固定, 感染的椎節亦有打入椎弓釘,但避開感染的中心,亦可見原本感染骨侵蝕的部位已有自體骨植入填補 |
手術後三天簡女士可以穿背架坐起
手術後一周, 發炎指數已從60下降至22
雖然細菌培養並無培養出確切的細菌 (可能是手術前已經使用抗生素治療造成的影響)
我們仍使用可以抗金黃色葡萄球菌(骨科感染最常見的細菌)的抗生素治療約三周,病患順利出院,出院時背部疼痛及大腿無力的情形均有顯著改善。
手術後一個月,發炎指數已經降到1 mg/dL (正常<5 mg/dL)
經過三年的追蹤骨髓炎無復發。
而X光的追蹤 , 亦可以看見第十二胸椎與第一腰椎已完全融合,內固定器無鬆脫的情形
 |
| 手術後12個月,可以看到補骨的地方已完全融合成功 |
從此病例我們可以瞭解,對於脊椎骨髓炎的治療,需針對每個病患的嚴重程度選擇不同的治療方式,包括各種手術與非手術的治療。
一個脊椎外科醫師亦須熟悉各種脊椎感染手術治療方法,才能針對不同情況的病患選擇最適當的治療策略,也能在當發現一開始的治療效果不佳時,能夠轉換到其他的方法解決問題。
參考:
.jpg)